萘醌类化合物的生产工艺(标准品)
从化学结构而言,其他脂类化合物主要有泛醌类的辅酶Q10和萘醌类的紫草素。紫草素具有显著的抗生育、抗炎、抗肿瘤、杀菌抗病毒、保肝和免疫调节等作用。由于紫草野生资源较少,难于人工训话培养,大量采挖势必造成资源枯竭及生态环境的破坏,借助植物细胞可避免由于过量采伐造成的生态环境的破坏。20试剂70-80年代,日本学者Tabata等*早成功诱导处硬紫草的愈伤组织,并影响紫草宁及其衍生物产量的条件进行了研究。80年代后期,我国学者也对紫草的组织培养进行了多方面的研究。目前,紫草素主要通过植物材料提取和组织培养的方法进行工业化的生产。
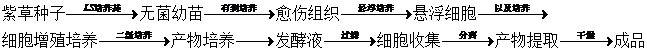
愈伤组织诱导
将紫草成熟种子置于含有![]() mol/L 2,4-D和
mol/L 2,4-D和![]() mol/L 激动素的LS琼脂培养基(琼脂1%)上,一直在黑暗、25℃下培养。种子萌发后于幼根部形成愈伤组织,再将此愈伤组织移植至含
mol/L 激动素的LS琼脂培养基(琼脂1%)上,一直在黑暗、25℃下培养。种子萌发后于幼根部形成愈伤组织,再将此愈伤组织移植至含![]() mol/L IAA和
mol/L IAA和![]() mol/L激动素LS琼脂培养基中。
mol/L激动素LS琼脂培养基中。
继代培养
将获得的1.5g鲜重愈伤组织移入装有80mL含有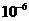 mol/L IAA和
mol/L IAA和![]() mol/L激动素LS液体培养基的300mL 三角瓶中,在100r/min转速下振荡培养,使细胞增殖。培养初起由于琼脂培养细胞产生紫草素易变质,细胞外观及不均一,但经14d培养的细胞转入新鲜培养基后,生长迅速的白色细胞大量繁殖,以后每隔14d移入新鲜培养基,经2-3代培养后,即可获得均一的细胞团。这样均一的细胞团经14d培养后增加约13倍。细胞移植时,用不锈钢制孔径40um的筛网手机细胞,按80mL培养基加1.5g鲜重细胞的比例进行接种。
mol/L激动素LS液体培养基的300mL 三角瓶中,在100r/min转速下振荡培养,使细胞增殖。培养初起由于琼脂培养细胞产生紫草素易变质,细胞外观及不均一,但经14d培养的细胞转入新鲜培养基后,生长迅速的白色细胞大量繁殖,以后每隔14d移入新鲜培养基,经2-3代培养后,即可获得均一的细胞团。这样均一的细胞团经14d培养后增加约13倍。细胞移植时,用不锈钢制孔径40um的筛网手机细胞,按80mL培养基加1.5g鲜重细胞的比例进行接种。
一级培养(细胞的增殖培养)标准品
接种在LS培养基内继代培养14d后,用如前所述的方法手机细胞,将1.5g鲜重细胞接种在80mL IMG-5培养基中,进行振荡培养,在细胞增加6-7倍后,自第10-11天掐对数增长长期结束,增殖速度开始降低。生产紫草素的种细胞的生长阶段对第2阶段在M-9培养基中的培养有很大影响。用对数增殖期的细胞作为种细胞,紫草素的得率*高。因此,从细胞收获量和紫草素生产考虑,在移植后的第9天结束第1阶段*为合适。此外MG-5培养基不含植物激素,所以不能用于维持细胞株的继代。
二级培养(生产紫草素的培养)标准品
如前述方法手机以及培养所得细胞,将2.4g鲜重细胞移入装有80mL M-9培养基300mL 三角瓶中,在100r/min转速下振荡培养。从培养第2天起,一部分细胞即呈红色,至第7天全部细胞完全呈鲜红色。经14d培养的细胞中紫草素含量为15%,即1L培养基中紫草素的收获量为15g.
产物的同步提取标准品
在培养过程中,细胞会将紫草素冲胞内分泌到胞外,附着的细胞壁表面,影响细胞对氧气和营养物质的吸收,抑制细胞生长和紫草素的合成,因此,使用某些有机溶剂在培养过程中同步萃取紫草素,即简化了次生代谢物的分离提纯工作,又降低了产物的反馈抑制。标准品在培养过程中添加维生素C,L-苯丙氨酸和正十六烷聚能提高紫草素产率,其中正十六烷效率*好,提高了5.8倍;加入0.12%的Tween-20.硬紫草细胞合成色素总产量达么可干细胞含18.15mg,比对照提高了4.2倍。另外,在培养过程中加入大孔吸附树脂吸附紫草色素,可使色素的产量提高6倍。
固定化培养技术
固定化培养运用于植物细胞已有几十年的历史,由于固定化技术可以反复利用细胞,增加细胞密度,大幅度提高有效成分的产量,目前,固定化培养议程为利用植物细胞培养生产次生物质研究的一个重要方向。吧硬紫草细胞包埋在海藻酸钙中固定化培养,30d后色素外泌达70%,而悬浮细胞仅有30%。如同时使用正十六烷进行萃取,色素外泌可达95%。研究表明固定化培养过程中,45d更换一次培养基,则180d后,细胞仍有产生色素的能力。